[FDA] Warning Letter Process
FDA 실사를 받고 난 후 지적 사항이 있는 경우 Form 483에 지적 사항(Obsersvation) 을 받게됩니다.
이 후 Observation에 대해 response 를 하는 후속 작업이 매우 중요한데요,
Warning letter 를 받을 것인 지 실사 통과가 되어 제품을 팔게 될 것 인 지 어떤 절차로 진행되는 걸까요!?
참고로 Form 483 에 대해서는 아래 링크에서 확인해보실 수 있습니다.
https://mypharm2021.tistory.com/34?category=505705
FDA 483 양식이란?
미국 FDA 감사를 준비하시거나 받아보신 분들은 483이라는 숫자가 정말 보기는 싫지만 익숙하실 것 같습니다. 483 양식이 무엇인 지는 FDA 사이트에서 쉽게 찾아보실 수 있습니다. FDA Form 483 ; Frequent
mypharm2021.tistory.com
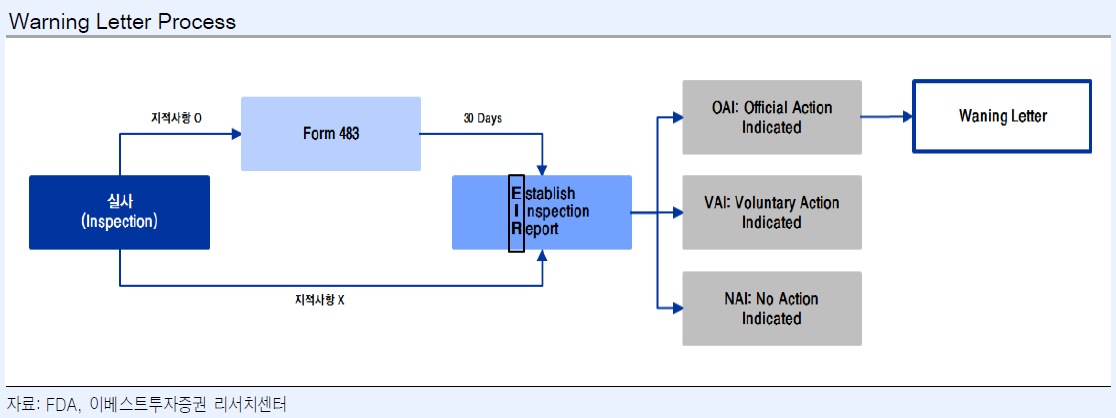
실사 이후 단계는 다음과 같이 진행됩니다.
483 에는 실사 지적 사항들이 담겨 있고, 이에 대한 공장에서의 Response를 약 2~3 주 내로 진행하게 됩니다.
이 내용이 검토된 후에 FDA Investigator 들은 실사 등급을 포함한 Establish Inspection Report 를 실사 종료 후 30일 이내에 발행합니다.
여기에 따른 등급은 3가지 인데요,
이 때 response에 적절히 대응 방법을 써서 FDA에 의해 accept 이 되면 No Action Indicated 또는 Voluntary Action Indicated 의 두가지 형태로 발행되게 됩니다.
VAI : Voluntary Action Indicated 는 추가 보완은 필요하지만 충분히 accept 을 할 수 있다는 FDA의 입장을 나타냅니다.
여기서 문제가 되는 부분은 OAI : Official Action Indicated 인데요, 모든 OAI 가 Warnining letter 로 이어지는 것은 아니지만 EIR - OAI 를 받은 날짜로부터 15일 내로 시정 문서를 FDA에 보내야 합니다.
이 시정이 적절하지 않은 경우 FDA에서는 Warning letter 를 발행하게 되는데요,
제약사에서 흔히 돌아다니는 Warning letter 족보 Form 483 은 이 과정을 거친 내용이라고 할 수 있겠습니다.
OAI : Official Action Indicated
VAI : Voluntary Action Indicated
NAI : No Action Indicated